Medidas específicas de prevención e higiene de procesos en medicina veterinaria
Prevención de infecciones y sepsis mediante catéteres intravasculares (ICRI y CABSI)
El objetivo de todas las medidas de higiene es reducir las infecciones nosocomiales y proteger a los empleados de las infecciones relacionadas con el trabajo. Para mantener la tasa de infección lo más baja posible, se debe analizar y optimizar todo el proceso y desarrollar estrategias protocolozadas.
Temas foco
Infecciones asociadas al catéter IV
Infecciones y sepsis causadas por catéteres intravasculares en medicina veterinaria. Las (ICRI) son las infecciones relacionadas con catéteres intravasculares y las (CABSI) son las infecciones del torrente sanguíneo asociadas a catéteres.
Terapia de infusión
Terapia de infusión
Manipulación de soluciones para perfusión: La preparación de soluciones para perfusión es una actividad aséptica. Se debe desinfectar la superficie de trabajo y realizar una desinfección higiénica de las manos (p. ej. SoftaMan®). Al preparar (cebar) la línea de infusión, se debe tener cuidado para garantizar que el accesorio no esté contaminado. Los sistemas de infusión con Primestop (p. ej. Intrafix® SafeSet) ayudan porque no es necesario retirar la tapa protectora de la línea de infusión para cebar. Otra ventaja de sistemas como Intrafix® SafeSet es que el sistema no funciona en vacío gracias al filtro AirStop. Esto permite reducir el número de desconexiones y reducir el riesgo de contaminación bacteriana del catéter. Dado que en medicina veterinaria es mucho más frecuente desconectar las soluciones de perfusión del paciente que en medicina humana, las recomendaciones aquí presentadas sólo pueden aplicarse de forma limitada. Pero precisamente por eso una buena higiene básica y de manos es crucial para la prevención.
Con cada desconexión, la línea de infusión debe cerrarse con un tapón de sellado nuevo y estéril y antes de volver a conectar el conector Luer Lock debe desinfectarse con un desinfectante en aerosol.
El uso de sistemas de infusión que funcionan sin ventilación (Ecoflac®) también parece tener un efecto positivo en la reducción de infecciones. [1]
Los filtros (filtros de bacterias y partículas como Sterifix®) son capaces de prevenir complicaciones graves en pacientes de cuidados intensivos, como por ejemplo para prevenir la aparición de SRIS y, por lo tanto, debe usarse en terapia de infusión para pacientes críticos y de cuidados intensivos. [2-4]
Instrucciones paso a paso
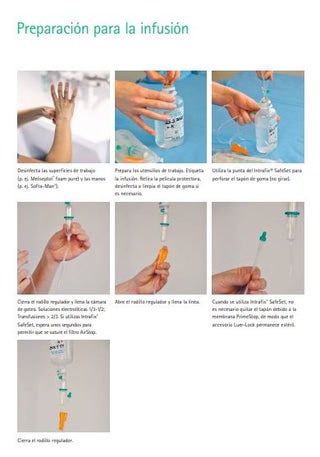
Preparación para la infusión
(Intrafix® SafeSet)
Vida útil de los sistemas de infusión: Los intervalos de cambio de los sistemas de infusión son de 96 horas. También se incluyen aquí llaves de tres vías (Discofix®) y vavulas sin aguja (Caresite®). Los sistemas de infusión que ejecutan soluciones lipídicas deben cambiarse cada 24 horas. Los sistemas de transfusión de hemoderivados deben cambiarse cada 6 horas. Si un sistema está contaminado o hay evidencia de CRBSI, se debe cambiar todo el sistema. [3-5]
Productos relacionados
Prevención de infecciones asociadas a catéteres vasculares y sepsis primaria.
Prevención de infecciones asociadas a catéteres vasculares y sepsis primaria
Punción de venas y colocación de catéteres venosos periféricos
Inserción: La vena siempre debe palpada antes de la inserción. Si hay signos de flebitis o inflamación local de la piel, se debe elegir otro sitio. El lugar de la punción debe afeitarse en una zona amplia. Puncionar venas o introducir un catéter intravenoso es una actividad aséptica, por lo que se debe desinfectar la superficie de trabajo y realizar una desinfección higiénica de manos. En un estudio prospectivo de medicina humana, el riesgo de complicaciones asociadas con PVK disminuyó significativamente después de la desinfección de manos, mientras que el lavado de manos no influyó en la tasa de complicaciones. [5] Luego se desinfecta el lugar de la punción. Esto se puede hacer rociando o limpiando la desinfección con un antiséptico a base de alcohol. Es importante prestar atención al tiempo de exposición.
Por razones de seguridad laboral, se deben utilizar guantes desechables con bajo contenido de gérmenes. Después de la desinfección se debe evitar palpar nuevamente el vaso. Se perfora el vaso y se avanza el catéter hacia el interior del vaso, asegurándose de que el catéter no toque el pelaje. Luego se fija y se enjuaga el catéter.
Dado que la inserción de catéteres venosos es una medida invasiva, la fecha debe anotarse en el expediente del paciente. Para catéteres para los cuales no se observó asepsia, por ejemplo en situaciones de emergencia, el catéter debe cambiarse dentro de las 24 horas. [5, 6]
Material: Varios estudios han demostrado la ventaja del poliuretano (PUR) y el teflón frente a otros materiales respecto a la flebitis. [7] Los catéteres de B. Braun como VasoVet®, Introcan® están fabricados con PUR.
Cuidados: Se debe realizar una desinfección higiénica de manos antes de cada manipulación. La indicación de PVK debe comprobarse diariamente. Se deben retirar los catéteres que ya no sean necesarios. El vendaje debe cambiarse diariamente y comprobar el lugar de la punción para detectar signos de infección/flebitis. Recomendamos utilizar una extensión con válvula sin aguja (CareSite®). La superficie lisa de CareSite® se puede desinfectar fácilmente rociándola o frotándola antes de administrar el medicamento. Además, se reduce la manipulación del propio catéter. Se puede suponer que esto da como resultado una menor irritación mecánica de la pared de la vena y evita el riesgo de contaminación del conector del catéter. Si se desconecta, la presión positiva en la válvula Caresite® evita que la sangre entre al catéter y se coagule. No se recomienda el uso de conectores en T ya que implican un mayor riesgo de contaminación en comparación con conectores en Y como Caresite®. [8]
Duración de la estancia: Apenas existen estudios sobre este tema en medicina veterinaria. Se puede suponer que, debido al gran número de complicaciones (mecánicas e inflamatorias) y a la mala higiene de las manos, en general, las afirmaciones al respecto deben tomarse con cautela. Un estudio determina que el mejor momento para cambiar el catéter es a las 36 horas. [9] Otros autores afirman hasta 72 horas. Aunque la tasa de colonización aumenta con el tiempo, esto no parece tener un efecto sobre la tasa de infección en comparación con los catéteres que se dejan colocados durante 96 horas. [10] Con un manejo higiénico y una buena gestión, se pueden evitar los cambios de rutina. Alternativamente, se debe establecer un intervalo basado en su propio análisis de riesgos. [6]
En cualquier caso, se debe cambiar el catéter y el equipo de infusión si hay signos de flebitis. [6, 11]
Formación: Una buena formación en la colocación de catéteres venosos es uno de los requisitos básicos para la prevención de infecciones de catéteres.
Instrucciones paso a paso

Catéteres venosos periféricos
(VasoVet® / IntroVet®)
Documentos relacionados
Catéter venoso central (CVC)
Colocación: En primer lugar se realiza una desinfección higiénica de las manos, se desinfecta la superficie de trabajo y se cubre de forma esterilizada. El sitio de punción se afeita en un área grande y se prepara como si fuera un procedimiento quirúrgico. Recomendamos realizar una limpieza previa de la piel con una espuma de polihexanida (Prontoderm® Foam). Esto elimina la suciedad y el sebo, así como los microorganismos. Después de un minuto de exposición, el área se puede secar con un hisopo limpio. A continuación se lleva a cabo la desinfección en 2 fases. El área se trata con hisopos estériles (hisopos de gasa Askina®) empapados en desinfectante y unas pinzas (p. ej., pinzas AESCULAP®) o mediante desinfección por pulverización. El veterinario también debe prepararse como para una operación, es decir, ponerse una mascarilla y un gorro, realizar una desinfección quirúrgica de las manos y ponerse una bata y guantes esterilizados (p. ej. Vasco® OP eco). Se cubre al paciente de forma esterilizada, se inserta y fija el catéter (p. ej., Certofix®). Se limpia el lugar de punción (Prontovet® Solución). Luego se aplica un gel para heridas de polihexanida (p. ej., ProntoVet® Gel) en el lugar de la punción. Luego se protege el catéter con una compresa estéril y una venda.
Cuidados: Antes de cada manipulación se debe realizar una desinfección higiénica de manos (p. ej. SoftaMan®). Las válvulas de conexión y la llave de tres vías deben desinfectarse antes de cada administración de medicamento o conexión. El apósito debe cambiarse al menos cada 72 horas o cuando esté sucio. El lugar de punción debe limpiarse con alcohol junto con un ingrediente activo remanente (ProntoVet®) y humedecerse con un gel antiséptico para heridas (ProntoVet® Gel). La manipulación del recorrido del catéter y de la llave de tres vías puede provocar una contaminación masiva del catéter; los estudios han demostrado una tasa de hasta el 20%. [12-16]
El uso de válvulas de conexión sin aguja (Caresite®) puede reducir la tasa de contaminación. [17-19] El requisito previo para esto es que el personal esté familiarizado con el producto y capacitado en su uso antes de introducir la válvula de conexión sin aguja.
Las válvulas de presión positiva parecen ser mejores que las válvulas de desplazamiento neutro o negativo cuando se usan durante 7 días (¡CareSite® es una válvula de presión positiva!). [17, 20] Se utiliza solución salina estéril al 0,9 % para lavar los catéteres. [21]
Duración de la estancia: La indicación debe comprobarse diariamente. Si hay evidencia de flebitis e inflamación en el lugar de la inyección, se debe retirar el CVC.
Formación: El personal debe recibir formación periódica en el ámbito de las ZVK.
Instrucciones paso a paso
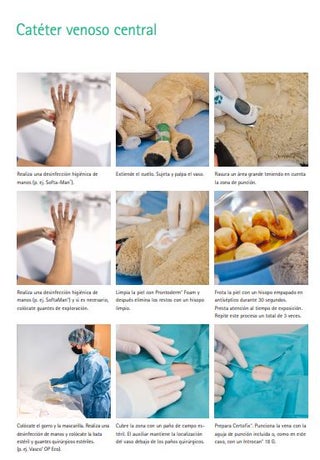
Catéter venoso central
(Certofix®)
Colocación Certofix®
Preparación de medicamentos
Preparación de medicamentos
La contaminación puede ocurrir durante la preparación o reconstrucción (preparación para el uso) de medicamentos, la extracción de medicamentos o la preparación de soluciones para infusión. Estos, a su vez, pueden provocar infecciones asociadas al catéter o infecciones en el lugar de la inyección.
Antes de cada preparación y reconstrucción, se debe desinfectar la superficie de trabajo (p. ej. Meliseptol®) y las manos (p. ej. Softa-Man®).
Se debe tener cuidado para asegurar la eliminación aséptica. El tapón de goma debe desinfectarse antes de retirarlo. Para envases multidosis, recomendamos utilizar Mini-Spike®. [22]
Productos relacionados
[1] Maki DG, Rosenthal VD, Salomao R, Franzetti F, Rangel-Frausto MS. Impact of switching from an open to a closed infusion system on rates of central line-associated bloodstream infection: a meta-analysis of time-sequence cohort studies in 4 countries. Infect Control Hosp Epidemiol 2011; 32(1):50 8.
[2] Jack T, Boehne M, Brent BE, Hoy L, Köditz H, Wessel A et al. In-line filtration reduces severe complications and length of stay on pediatric intensive care unit: a prospective, randomized, controlled trial. Intensive care medicine 2012; 38(6):1008 16.
[3] Prävention von Infektionen, die von Gefäßkathetern ausgehen: Hinweise zur Implementierung Informativer Anhang 2 zur Empfehlung der Kommission für Krankenhaushygiene und Infektionsprävention (KRINKO) beim Robert Koch-Institut. Bundesgesundheitsbl 2017; 60(2):231 44.
[4] Prävention von Infektionen, die von Gefäßkathetern ausgehen: Teil 1 – Nichtgetunnelte zentralvenöse Katheter Empfehlung der Kommission für Krankenhaushygiene und Infektionsprävention (KRINKO) beim Robert Koch-Institut. Bundesgesundheitsbl 2017; 60(2):171 206.
[5] Department of Health and Human Services, Centers for Disease Control and Prevention. Guidelines for the Prevention of Intravascular Catheter-Related Infections (2011).
[6] Prävention von Infektionen, die von Gefäßkathetern ausgehen: Teil 2 – Periphervenöse Verweilkanülen und arterielle Katheter Empfehlung der Kommission für Krankenhaushygiene und Infektionsprävention (KRINKO) beim Robert Koch-Institut. Bundesgesundheitsbl 2017; 60(2):207-15.
[7] Müller C, Gehlen H. Katheter-assoziierte Venenerkrankungen beim Pferd – Diagnose und Therapie in der Praxis. Tierarztl Prax Ausg G Grosstiere Nutztiere 2016; 44(3):187-94.
[8] Jones ID, Case AM, Stevens KB, Boag A, Rycroft AN. Factors contributing to the contamination of peripheral intravenous catheters in dogs and cats. Vet Rec 2009; 164(20):616-8.
[9] Crisi PE, Santis F de, Aste G, Tiscar PG, Mosca F, Gasparini A et al. Inflammatory, Mechanical and Infectious Complications Associated with Peripheral Intravenous Catheters in Dogs and Cats: A Risk Factor Analysis. Vet Sci 2022; 9(3).
[10] Lai KK. Safety of prolonging peripheral cannula and i.v. tubing use from 72 hours to 96 hours. Am J Infect Control 1998; 26(1):66-70.
[11] Naomi P. O'Grady, M.D.1, Mary Alexander, R.N.2, Lillian A. Burns, M.T., M.P.H., C.I.C.3, E. Patchen Dellinger, M.D.4, Jeffery Garland, M.D., S.M.5, Stephen O. Heard, M.D.6, Pamela A. Lipsett, M.D.7, Henry Masur, M.D.1, Leonard A. Mermel, D.O., Sc.M.8, Michele L. Pearson, M.D.9, Issam I. Raad, M.D.10, Adrienne Randolph, M.D., M.Sc.11, Mark E. Rupp, M.D.12, Sanjay Saint, M.D., M.P.H. Guidelines for the Prevention of Intravascular Catheter-Related Infections, 2011 2017.
[12] Oto J, Nishimura M, Morimatsu H, Katayama H, Onodera M, Takahashi H et al. Comparison of contamination between conventional three-way stopcock and needleless injection device: a randomized controlled trial. Med Sci Monit 2007; 13(10):CR417-21.
[13] Sitges-Serra A, Puig P, Liñares J, Pérez JL, Farreró N, Jaurrieta E et al. Hub colonization as the initial step in an outbreak of catheter-related sepsis due to coagulase negative staphylococci during parenteral nutrition. JPEN J Parenter Enteral Nutr 1984; 8(6):668-72.
[14] Sitges-Serra A, Hernández R, Maestro S, Pi-Suñer T, Garcés JM, Segura M. Prevention of catheter sepsis: the hub. Nutrition 1997; 13(4 Suppl):30S-35S.
[15] Lockman JL, Heitmiller ES, Ascenzi JA, Berkowitz I. Scrub the hub! Catheter needleless port decontamination. Anesthesiology 2011; 114(4):958.
[16] Liñares J, Sitges-Serra A, Garau J, Pérez JL, Martín R. Pathogenesis of catheter sepsis: a prospective study with quantitative and semiquantitative cultures of catheter hub and segments. J Clin Microbiol 1985; 21(3):357-60.
[17] Costello JM, Morrow DF, Graham DA, Potter-Bynoe G, Sandora TJ, Laussen PC. Systematic intervention to reduce central line-associated bloodstream infection rates in a pediatric cardiac intensive care unit. Pediatrics 2008; 121(5):915-23.
[18] Yébenes JC, Vidaur L, Serra-Prat M, Sirvent JM, Batlle J, Motje M et al. Prevention of catheter-related bloodstream infection in critically ill patients using a disinfectable, needle-free connector: a randomized controlled trial. Am J Infect Control 2004; 32(5):291-5.
[19] Bouza E, Muñoz P, López-Rodríguez J, Jesús Pérez M, Rincón C, Martín Rabadán P et al. A needleless closed system device (CLAVE) protects from intravascular catheter tip and hub colonization: a prospective randomized study. J Hosp Infect 2003; 54(4):279-87.
[20] Harnage S. Seven years of zero central-line-associated bloodstream infections. Br J Nurs 2012; 21(21):S6, S8, S10-2.
[21] Vose J, Odunayo A, Price JM, Daves M, Schildt JC, Tolbert MK. Comparison of heparinized saline and 0.9% sodium chloride for maintaining central venous catheter patency in healthy dogs. PeerJ 2019; 7:e7072.
[22] Popp W. und Zastrow K-D. Hygiene-Tipp, Dezember 2008 Deutsche Gesellschaft für Krankenhaushygiene: Einzeldosisampullen oder Mehrdosenbehältnisse für Injektionen.





















